Información sobre “Compuesto: guía esencial con tipos, propiedades y ejemplos”
Autor: Equipo Enciclo
Revisión editorial: Editor en jefe — Enciclo ( Quiénes somos )
Última actualización: 31 de agosto de 2025
Metodología y fuentes: Metodología y fuentes
Revisado por: Marian C. — Social Sciences & Research Methods
Compuesto: guía esencial con tipos, propiedades y ejemplos
Compuesto en química: sustancia pura formada por elementos distintos en proporciones fijas. Aquí verás tipos, propiedades y ejemplos claros para entenderlo sin complicaciones.
Compuesto: contexto y punto de partida
Imagina una mesa de laboratorio donde unas esferas de colores se juntan como piezas de rompecabezas. Esa escena sencilla explica un compuesto: una sustancia única nacida cuando átomos de elementos diferentes se unen químicamente en proporciones definidas. Al formar el compuesto, dejan atrás sus rasgos originales y emergen como algo nuevo.
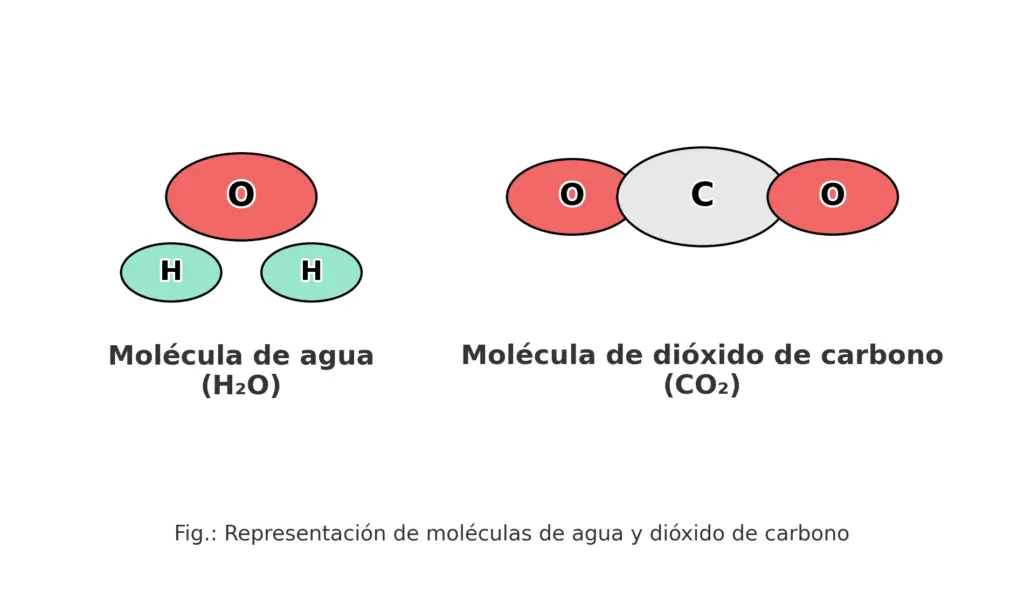
En la vida cotidiana convivimos con compuestos todo el tiempo: bebemos agua (H₂O), cocinamos con sal (NaCl), limpiamos con bicarbonato de sodio (NaHCO₃) o respiramos dióxido de carbono (CO₂). Detrás de cada nombre hay una estructura, una fórmula y una historia sobre cómo la materia se organiza.
Por qué importan los compuestos (definición rápida)
Respuesta rápida: en química, un compuesto es una sustancia pura formada por dos o más elementos diferentes unidos químicamente en proporciones fijas. Se descompone en sustancias más simples sólo mediante reacciones químicas.
Esta definición distingue a los compuestos de las mezclas (como el aire o el agua con sal), donde los componentes coexisten sin unirse químicamente y sus proporciones pueden variar.
Cómo reconocer un compuesto: propiedades que lo distinguen
El agua ofrece un ejemplo clásico: está formada por hidrógeno y oxígeno en una proporción fija de masa 1:8. Por eso una muestra de agua pura siempre contiene aproximadamente 11,2 % H y 88,8 % O. Esa constancia se conoce como ley de proporciones definidas, una brújula que guía buena parte de la química.
Otro caso familiar es el CO₂: una molécula lineal con un átomo de carbono unido a dos de oxígeno. En ambos ejemplos, las partículas elementales se enlazan en un diseño específico; alterar ese diseño rompe el compuesto y genera otros.
Propiedades de un compuesto, en la práctica
- No se separan por métodos físicos comunes (imán, filtración, decantación). Para dividir un compuesto hacen falta reacciones químicas. Un clásico: si acercas un imán al sulfuro de hierro (FeS), el hierro no se separa porque ya no está como metal libre, sino enlazado químicamente con el azufre.
- Nuevas propiedades: el compuesto no “se parece” a sus elementos. Hidrógeno (combustible) y oxígeno (favorece la combustión) forman agua, que justamente apaga incendios. El NaCl contrasta con sus componentes: sodio metálico, blando y reactivo, y cloro gaseoso y tóxico; la sal es un sólido cristalino estable y comestible.
- Composición definida: los elementos están presentes en proporciones fijas para cada compuesto. En cursos introductorios predominan compuestos binarios (dos elementos) y ternarios; los que incluyen más de cuatro elementos existen, sobre todo en materiales complejos y biomoléculas, pero son menos comunes en el nivel básico.
- Homogeneidad: una muestra de un compuesto es uniforme en composición y propiedades. Además, exhibe puntos de fusión y ebullición característicos (por ejemplo, el hielo funde a 0 °C en condiciones estándar).
- Energía en juego: al formarse o descomponerse un compuesto hay cambios de energía. La fotosíntesis es un proceso endotérmico (absorbe energía); la combustión de una vela es exotérmica (libera energía).
Compuestos, moléculas y enlaces
Un compuesto molecular está hecho de moléculas formadas por enlaces covalentes entre átomos de distintos elementos. Otros compuestos, como NaCl o CaCO₃, son iónicos: sus unidades estructurales son redes de iones. En ambos casos, lo decisivo es que haya elementos diferentes enlazados químicamente.
Tipos de compuestos: orgánicos e inorgánicos
Orgánicos: originalmente asociados a seres vivos, hoy se definen como compuestos del carbono (hidrocarburos y derivados). Entre los más conocidos están los carbohidratos, lípidos (grasas), proteínas y ácidos nucleicos: pilares de la vida. También son orgánicos el petróleo y el gas natural.
Inorgánicos: abarcan los compuestos que no se clasifican como orgánicos. Incluyen sustancias clave en el día a día: agua, cloruro de sodio, bicarbonato de sodio, carbonato de calcio, ácido sulfúrico, ácido nítrico, ácido fosfórico y amoníaco, entre muchos otros.
Ejemplos de compuestos en la vida diaria
- En la cocina, el bicarbonato de sodio (NaHCO₃) hace crecer una masa al liberar CO₂ en una reacción ácido–base.
- En el medicamento, el carbonato de calcio (CaCO₃) aporta calcio dietético.
- En la industria, el ácido sulfúrico (H₂SO₄) es insumo de baterías y fertilizantes.
Cómo se forman y cómo se separan los compuestos
Los compuestos nacen cuando los átomos comparten electrones (enlaces covalentes) o los transfieren (enlaces iónicos). La estabilidad del compuesto depende del arreglo electrónico y de la energía del sistema: si el nuevo enlace reduce la energía total, la unión es favorable.
Para separar un compuesto hay que romper enlaces: electrólisis del agua, descomposición térmica del carbonato de calcio a óxido de calcio y CO₂, o reacción del FeS con ácidos. Ninguno de estos procesos es puramente físico; todos implican reacciones químicas.
Proporciones en un compuesto y su fórmula
La fórmula química indica la proporción atómica (H₂O, CO₂, NH₃). Cuando la composición es constante y exacta, hablamos de compuestos estequiométricos. En algunos sólidos iónicos aparecen no‑estequiometrías (ligeras desviaciones en la relación atómica), habituales en materiales con defectos cristalinos; aún así, siguen siendo compuestos.
Compuesto vs mezcla y molécula: dudas aclaradas
¿Toda molécula es un compuesto? No. Existen moléculas elementales como O₂, N₂ o Cl₂: están hechas de un solo elemento, por lo que no son compuestos. Un compuesto molecular sí es una molécula con elementos diferentes.
¿En qué se diferencia de una mezcla? En una mezcla, las proporciones varían y cada componente conserva sus propiedades (por ejemplo, arena con sal). En un compuesto, las proporciones son fijas y surge una sustancia nueva.
¿Por qué cambian tanto las propiedades? Porque las propiedades emergen de la estructura: la manera en que los átomos se enlazan y se ordenan en el espacio determina solidez, reactividad, puntos de fusión y ebullición, color, toxicidad y más.
Ejemplos de compuestos y su fórmula molecular
Aquí hemos enumerado algunos compuestos comúnmente utilizados y sus fórmulas moleculares en forma de tabla que debes recordar para el examen.
| Nombre compuesto | Fórmula molecular |
|---|---|
| Agua | H₂O |
| Dióxido de carbono | CO₂ |
| Metano | CH₄ |
| Cloruro de sodio (sal) | NaCl |
| Amoníaco | NH₃ |
| Glucosa | C₆H₁₂O₆ |
| Ácido clorhídrico | HCl |
| Ácido sulfúrico | H₂SO₄ |
| Ácido acético (vinagre) | CH₃COOH |
| Etanol (alcohol) | C₂H₅OH |
| Carbonato de calcio | CaCO₃ |
| Bicarbonato de sodio (bicarbonato de sodio) | NaHCO₃ |
| Oxígeno (oxígeno diatómico) | O₂ |
| Nitrógeno (nitrógeno diatómico) | N₂ |
| Nitrato de potasio (salitre) | KNO₃ |
| Hidróxido de calcio (cal apagada) | Ca(OH)₂ |
| Sulfato de magnesio (sal de Epsom) | MgSO₄ |
| Ácido fosfórico | H₃PO₄ |
| Ácido nítrico | HNO₃ |
| Hidróxido de sodio (sosa cáustica) | NaOH |
| Benceno | C₆H₆ |
| Óxido de aluminio | Al₂O₃ |
| Peróxido de hidrógeno | H₂O₂ |
| Monóxido de carbono | CO |
Diferencia entre elemento y compuesto
En esta sección, comprenderemos la diferencia básica entre elemento y compuesto, uno de los temas más discutidos en química. Aquí, hemos enumerado las diferencias en forma de tabla para ayudarte a comprenderlas mejor.
| Característica | Elemento | Compuesto |
|---|---|---|
| Definición: | Una sustancia pura que no puede descomponerse en sustancias más simples por medios químicos. | Una sustancia única que puede descomponerse en sustancias más simples mediante alguna reacción o cambio químico adecuado. |
| Relación: | Está formado por un solo tipo de átomo. | Está formado por dos o más tipos diferentes de átomos. |
| Ejemplo: | Hidrógeno (H), Oxígeno (O), Oro (Au). | Agua (H₂O), cloruro de sodio (NaCl), dióxido de carbono (CO₂). |
| Estructura: | Existe como átomos individuales o en formas como moléculas diatómicas. Por ejemplo, los gases nobles, O₂, N₂, etc. | Tiene una fórmula química y una estructura definidas, que representan la proporción de átomos. Por ejemplo, el agua (H₂O) está compuesta por 2 H y 1 O. |
| Visibilidad: | Los elementos pueden ser visibles como sólidos, líquidos o gases. Por ejemplo, el mercurio es líquido, mientras que el oxígeno es gas. | Los compuestos pueden ser visibles como sólidos, líquidos o gases, según su estado a temperatura ambiente. Por ejemplo, el agua es un líquido, mientras que la sal es un sólido. |
| Propiedades químicas: | Cada elemento tiene propiedades químicas únicas que los distinguen entre sí. | Los compuestos tienen propiedades distintas a las de los elementos constituyentes. Por ejemplo, el agua tiene propiedades diferentes a las del hidrógeno y el oxígeno. |
| Propiedades físicas: | Las propiedades físicas comunes de los elementos son el punto de fusión, el punto de ebullición, la densidad, el color, la conductividad, etc. | Un compuesto tiene sus propias propiedades físicas, que pueden diferir significativamente de las de los elementos que lo componen. Por ejemplo, el sodio es un metal, el cloro es un gas, pero el NaCl es un sólido. |
| Formación: | De origen natural o sintetizado en laboratorios. | Formado a través de reacciones químicas. |
| Ejemplos en la naturaleza: | Se encuentra como sustancia pura en la naturaleza. | Se encuentran en la naturaleza como combinaciones. Por ejemplo, agua, aire, etc. |
Preguntas frecuentes para compuesto
¿Qué es un compuesto en química?
Un compuesto es una sustancia pura formada por dos o más elementos diferentes en proporciones definidas y unidas químicamente. Sólo se separa por reacciones químicas.
¿Cuáles son cinco compuestos de uso cotidiano?
Cinco ejemplos cercanos: sal común (NaCl), agua (H₂O), jabón (familia de sales orgánicas), bicarbonato de sodio (NaHCO₃) y azúcar (sacarosa, C₁₂H₂₂O₁₁).
¿Un compuesto debe tener propiedades parecidas a las de sus elementos?
No. Las propiedades de un compuesto suelen diferir radicalmente de las de sus elementos. Es el caso del NaCl frente a Na y Cl₂, o del agua frente a H₂ y O₂.
¿Cuáles son ejemplos familiares de compuestos?
HCl, CH₃COOH, H₂SO₄, NH₃, HNO₃, CaCO₃, NaHCO₃, entre muchos otros presentes en casa, industria y laboratorio.
¿Qué son los compuestos estequiométricos y no estequiométricos?
Los estequiométricos tienen composición atómica definida (por ejemplo, H₂O, NH₃). Los no estequiométricos muestran ligeras variaciones en la relación de átomos, comunes en sólidos iónicos con defectos; por ejemplo, ciertos sulfuros de cobre pueden acercarse a fórmulas como Cu₂S.
Lo que aprendimos sobre compuesto
Un compuesto no es una mezcla: nace de enlaces químicos entre elementos distintos en proporciones fijas y por eso exhibe propiedades nuevas. Entendimos cómo distinguirlo de las mezclas, qué propiedades caracterizan a los compuestos, sus tipos (orgánicos e inorgánicos) y por qué la energía está presente en su formación y descomposición. Con estos conceptos, leer una fórmula —H₂O, CO₂, NaCl— se vuelve una forma de narrar la materia.
Referencias para compuesto